Wernberg e Lucarelli
Surg Clin N Am 94(2014): 343-360
GALLBLADDER CANCER
Hickman e Contreras
Surg Clin N Am 99(2019) : 337-355
REVISÃO SISTEMÁTICA E METANÁLISE DOS RESULTADOS DA SOBREVIDA DO CÂNCER DE VESÍCULA BILIAR T2A E T2B
Alrawashdeh e cols – HPB 2022, 24, 789-796
O câncer das vias biliares incluem aqueles que comprometem os ductos biliares intrahepáticos (colangiocarcinoma intrahepático ou periférico), hilares (colangiocarcinoma hilar ou tumor de Klatskin), extrahepáticos (colangiocarcinoma distal) e vesicular biliar. Todos são do tipo adenocarcinoma e originam-se no epitélio biliar, sendo o câncer de vesicular biliar o mais comum deles.
O Câncer de Vesícula Biliar (CVB) é raro, apesar de ser o mais comum do trato biliar , representa 1,2% de todos os tipos de câncer e 1,7% das mortes por câncer no mundo e a ressecção cirúrgica permanence sendo o único tratamento potencialmente curativo.
Existem variações regionais na sua incidência, que é maior no norte da Europa, Índia e Chile. Sua incidência aumenta com a idade, ocorrendo geralmente após 65 a 70 anos, ocorrendo mais em mulheres (1,3 a 3,5:1).
Com o advento da laparoscopia, aumentou o diagnóstico incidental ou em estágios precoces.Aproximadamente 1 em 250 colecistectomias laparoscópicas pode ter diagnóstico patológico de câncer.
Os sintomas confundem-se com os de colecistite.
Os principais fatores de risco para CVB são sexo feminino, idade avançada, colelitíase ou outra doença benigna da vesicular biliar (VB) – 0,7% das colecistectomias laparoscópicas apresentam CVB incidental , infecção crônica por Salmonella ou H pilori, anomalias da junção pancreatobiliar, VB em porcelana, pólipos da VB e obesidade, história familiar de colelitíase, colecistite crônica, tabagismo, exposição a benzeno, alto consumo de carboidratos, diarréia crônica.
Vários autores já publicaram a associação da inflamação da parede da vesicular com o câncer.
Piehler e Crichlow publicaram revisão de mais de 2000 pacientes com câncer de vesicular biliar e encontraram a presença de cálculos em 73,9% dos pacientes. A maioria dos pacientes (70 a 88%) portadores de câncer na vesicular biliar têm histórico de calculus, mas a incidência de câncer em portadores de calculus varia de 0,3 a 3%. Diehl publicou relação do câncer de vesicular com o tamanho do cálculo, mostrando um risco 10 vezes maior em cálculos > 3 cm.
Pólipos de VB são encontrados em até 12% das colecistectomias e 5 a 7% dos US realizados, mas apenas 0,6% são malignos. Apresentam risco de malignidade se > 1 cm , idade > 50 anos, colecistopatia calculosa, pólipo solitário e CEP associada. Quando > 2 cm frequentemente são neoplásicos. 2 a 7% dos casos de vesicula em porcelana podem desenvolver câncer.
A AHPBA sugere que pólipos > 1 cm com pedículo vascular devem ser removidos devido a elevada incidência de câncer.
Vesícula em porcelana ou calcificações da parede da VB estão associadas a câncer em 2 a 7% dos pacientes.
Comparado com colangiocarcinoma, o CVB tem pior sobrevida e menor tempo de recorrência.
Patologia
A parede da vesicular biliar é desprovida de submucosa, sendo composta por mucosa, lamina própria, muscular , tecido conectivo perimuscular e serosa.
Nos exames de imagem o CVB pode se apresentar como uma massa, pólipos ou simplesmente espessamento da parede da VB, principalmente quando esse é irregular ou perde a diferenciação entre as camadas da parede.
TC é o metodo mais sensível e específico para determinar o estadiamento linfonodal e peritoneal, com 99% de sensibilidade e 76% de especificidade.
Linfonodos fora do hilo hepático pioram muito o prognóstico.
PET TC mostrou 93% de sensibilidade e 80% de especificidade e modifica em 23% o estadiamento da TC.
Biópsias são indicadas em casos com algum critério de irressecabilidade.
Laparoscopia diagnóstica pode evitar em 50% laparotomias desnecessárias em doenças irressecáveis ou metastáticas.
Colecistectomias radicais podem ser feitas por laparoscopia em casos com diagnóstico pré-op.
A maior sobrevida é obtida em CVB incidental .
Extravazamento de bile durante a retirada da VB pode aumentar a recorrência e piorar a sobrevida.
As ressecções devem ser R0 e não há diferença de sobrevida entre ressecção não regrada, segmentectomia ou hepatectomia desde que R0 sejam alcançada.
O colédoco deve ser ressecado quando o ducto cístico está comprometido.
Linfadenectomia deve ser feita para estadiamentos T1b ou maior e deve envolver o hilo hepático, o ligamento gastrohepático e o espaço retroduodenal. Linfonodos celíacos e intercavoaórticos devem ser considerados metastases.
Implantes no portal da laparoscopia indicam doença avançada e é questionável o benefício da ressecção. Ressecções empíricas não mudam o prognóstico e aumentam a incidência de hernias.
Fatores de risco para ressecções não R0 são T3, invasão perineural e invasão linfovascular.
Todos os pacientes com CVB incidental com estadiamento T1b ou maior devem ser submetidos a ressecção.
CVB localizados na superfície hepatica tem pior prognóstico que os localizados na superfície peritoneal.
O momento da reoperação deve ser entre 4 e 8 semanas após a colecistectomia segundo estudo multicêntrico de Ethun e cols (JAMA 2017).
O tratamento adjuvante geralmente é reservado a ressecções R1, T3 e/ou comprometimento linfonodal. Alguns estudos mostram benefício da radioquimioterapia (RQT) adjufante nestas situações desde que realizadas até 3 meses após a cirurgia.
Kim e cols (Radiat Oncol 2017) propuseram RQT para pacientes com T2 e/ou R1.
Análise do NCDB (Cancer Cytopathol 2018;124(1):74–83) mostrou benefícios de RQT em pacientes com ressecção R0 e linfonodos positivos. RQT foi também mais eficaz que QT em casos irressecáveis.
Imunoterapia ainda não estabeleceu seu papel no tratamento do CVB.
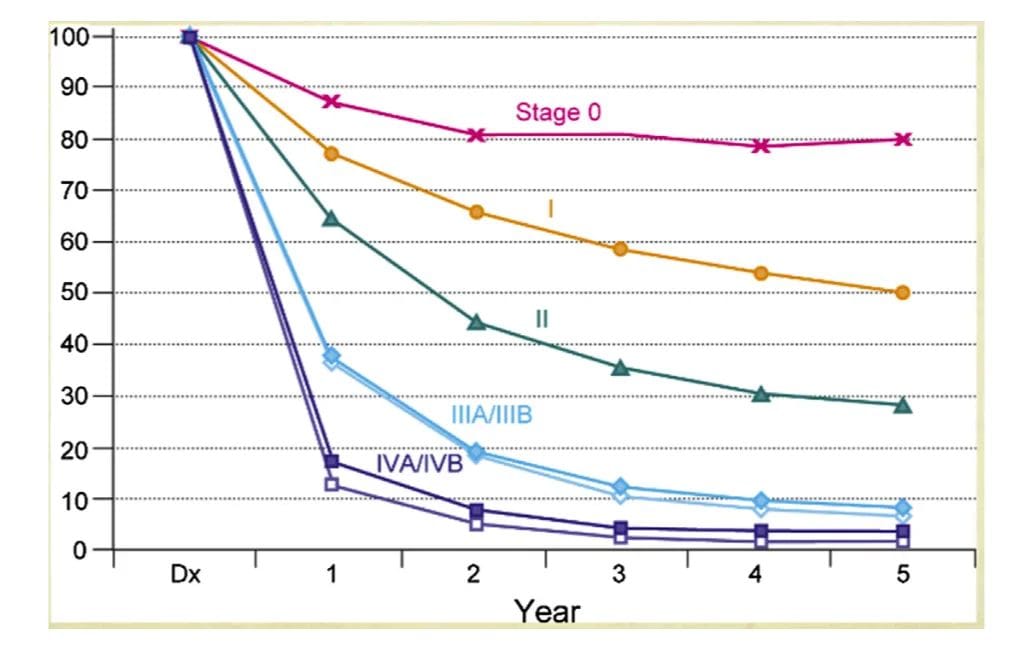
O estadiamento do tumor é o fator preditivo mais importante na determinação da sobrevida.
O seguimento pós-operatório deve ser feito com imagens a cada 6 meses por 2 anos e depois anualmente até completar 5 anos.
Estadiamento – 8th Ed AJCC (2018)
T1a- invade a lamina própria
T1b- invade a camada muscular
T2 – diferencia a superfície peritoneal da hepatica
T2a – peritoneal
T2b- hepatica
T3- compromete a serosa peritoneal ou invade o fígado ou outro órgão adjacente
T4- invade veia porta, art hepatica ou 2 ou mais órgãos extrahepáticos
N – número de linfonodos comprometidos
N1 – 1 a 3 LN
N2 – 4 ou + LN
M- metastases
M0 – ausentes
M1 – presentes
Estadio I
T1
Estadio IIa
T2a
Estadio IIb
T2b
Estadio IIIa
T3
Estadio IIIb
T3N1
Estadio IV
T4
Estadio IVA Estadio IVB
T4 N2 e/ou M1
Ainda há dúvidas quanto ao melhor tratamento para turmores T2.
Na última edição do AJCC TNM , T2 foi dividido em T2a – tumor na face visceral da vesicula e T2b – tumor na face hepatica.
Estudo de Alrawashdeh e cols (Un. Edinburgh) reviu a literature sobre os tratamentos em tumores T2a e T2b.
Foram identificados 68 estudos dos quais 15 foram incluídos, compreendendo 2531 pacientes (1332 T2a e 1199 T2b), a maioria de um único centro e retrospectivos.
Metanálise envolvendo 9 estudos mostrou pior sobrevida no grupo T2b (HR 2,18).
O tempo livre de doença também foi maior no grupo T2a e a recorrência foi maior no T2b, sendo que T2b recorre mais localmente, no fígado e em LN enquanto T2a recorre mais nos LN.
Ressecções hepáticas e linfonodais têm sido empregadas igualmente em T2a e T2b. A linfadenectomia melhora a sobrevida nos T2, de forma incerta nos T2a mas de forma significativa nos T2b.
QT adjuvante tem sido mais utilizada em casos T2b.
A diferença entre T2a e T2b provavelmente está na drenagem venosa e linfática, que é mais exuberante na face da VB junto ao fígado.
Alguns autores já demonstraram maior comprometimento linfonodal nos tumores T2b, sendo a as cadeias comprometidas na seguinte ordem de frequência : cístico, pericoledociano, hilo hepático, retroportal. Existem cerca de 20 veias na face hepatica e cerca de 2 na face peritoneal, fator que pode influenciar na disseminação do tumor.
Quando se investiga a invasão do parenquima hepático pelos tumores T2, todos encontram-se na face hepatica e não ultrapassam 3 cm na intimidade do parenquima hepático.
Metanálises mostram benefícios da ressecção hepatica nos tumores T2b , não confirmando benefícios nos tumores T2a.
A metanálise apresentada aqui comparando T2a com T2b mostra sobrevida significativamente melhor com menor recorrência nos T2a, mostrando a importância da localização tumoral na definição da conduta e no prognóstico. T2b beneficiam-se da ressecção hepatica, o que não está claro nos T2a, e ambos beneficiam-se de linfadenectomia, principalmente T2b.

